Un niño de Estados Unidos que nació el pasado verano con una enfermedad rara y grave ha sido tratado con éxito con una terapia de edición genética personalizada desarrollada en tiempo récord. La terapia restaura la capacidad de las células del hígado de producir una enzima vital.
El avance demuestra por primera vez que es viable desarrollar terapias de edición genética para pacientes individuales aquejados de enfermedades raras. Aunque cada una de estas enfermedades afecta a un número pequeño de personas, la suma de todas ellas afecta a un número grande: unos tres millones de personas en España tienen alguna de las 7.000 enfermedades raras identificadas, según datos de la Federación Española de Enfermedades Raras (FEDER).
La primera terapia de este tipo “se ha desarrollado en condiciones de emergencia para una enfermedad metabólica devastadora”, escriben los autores del avance en la revista The New England Journal of Medicine, donde hoy publican el caso, coincidiendo con su presentación en el congreso de la Sociedad Americana de Terapia Génica y Celular en Nueva Orleans. Pero “anticipamos que el rápido despliegue de terapias de edición genética individualizadas se convertirá en rutinario para muchas enfermedades genéticas”.

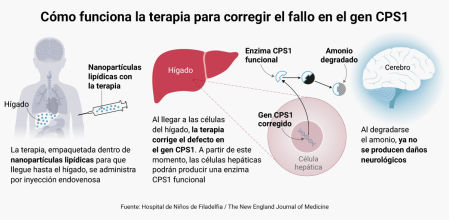
Cómo funciona el tratamiento
Los médicos e investigadores han creado una terapia individualizada para corregir un fallo en el gen CPS1
Célula
hepática
Hígado
Gen CPS1
alterado
Al no poder producir una
enzima CPS1 funcional en
el hígado, no puede degradar
el amonio que se produce por
la digestión de las proteínas
de la dieta
Enzima CPS1 disfuncional
Amonio
Cerebro
El amonio causa daños neurológicos irreversibles
La terapia, que se ha empaquetado dentro de nanopartículas lipídicas para que llegue hasta el hígado, se administra por inyección endovenosa
Nanopartículas lipídicas con
la terapia
Hígado
Célula
hepática
Hígado
Gen CPS1
corregido
Al llegar a las células
del hígado, la terapia
corrige el defecto en
el gen CPS1. A partir de
este momento, las
células hepáticas podrán
producir una enzima
CPS1 funcional
Enzima CPS1 funcional
Amonio
degradado
Cerebro
Al degradarse
el amonio, ya no
se producen daños
neurológicos
La terapia que se administra en
las nanopartículas tiene dos partes:
Una guía molecular lleva al editor
genético hasta el punto exacto
del genoma donde debe actuar
El editor genético CRISPR sustituye
la instrucción genética defectuosa
por la versión correcta
Fuente: Hospital de Niños de Filadelfia
/ The New England Journal of Medicine
GUYANA GUARDIAN

Cómo funciona el tratamiento
Los médicos e investigadores han creado una terapia individualizada para corregir un fallo en el gen CPS1
Célula
hepática
Hígado
Gen CPS1
alterado
Al no poder producir una
enzima CPS1 funcional en
el hígado, no puede degradar
el amonio que se produce por
la digestión de las proteínas
de la dieta
Enzima CPS1 disfuncional
Amonio
Cerebro
El amonio causa daños neurológicos irreversibles
La terapia, que se ha empaquetado dentro de nanopartículas lipídicas para que llegue hasta el hígado, se administra por inyección endovenosa
Nanopartículas lipídicas con
la terapia
Hígado
Célula
hepática
Hígado
Gen CPS1
corregido
Al llegar a las células
del hígado, la terapia
corrige el defecto en
el gen CPS1. A partir de
este momento, las
células hepáticas podrán
producir una enzima
CPS1 funcional
Enzima CPS1 funcional
Amonio
degradado
Cerebro
Al degradarse
el amonio, ya no
se producen daños
neurológicos
La terapia que se administra en
las nanopartículas tiene dos partes:
Una guía molecular lleva al editor
genético hasta el punto exacto
del genoma donde debe actuar
El editor genético CRISPR sustituye
la instrucción genética defectuosa
por la versión correcta
Fuente: Hospital de Niños de Filadelfia
/ The New England Journal of Medicine
GUYANA GUARDIAN

Cómo funciona el tratamiento
Los médicos e investigadores han creado una terapia individualizada para corregir un fallo en el gen CPS1
Enzima CPS1 disfuncional
Amonio
Cerebro
Hígado
Gen CPS1
alterado
El amonio causa daños neurológicos irreversibles
Al no poder producir una enzima CPS1 funcional en
el hígado, no puede degradar
el amonio que se produce por
la digestión de las proteínas
de la dieta
Célula
hepática
La terapia, que se ha empaquetado dentro de nanopartículas lipídicas
para que llegue hasta el hígado, se
administra por inyección endovenosa
Nanopartículas lipídicas con la terapia
Hígado
Enzima CPS1 funcional
Amonio
degradado
Cerebro
Hígado
Gen CPS1
corregido
Al degradarse el amonio, ya no se producen daños neurológicos
Al llegar a las células
del hígado, la terapia
corrige el defecto en el
gen CPS1. A partir de este
momento, las células hepáticas
podrán producir una enzima CPS1 funcional
Célula
hepática
La terapia que se administra en
las nanopartículas tiene dos partes:
Una guía molecular lleva al editor
genético hasta el punto exacto
del genoma donde debe actuar
El editor genético CRISPR sustituye
la instrucción genética defectuosa
por la versión correcta
Fuente: Hospital de Niños de Filadelfia / The New England Journal of Medicine
GUYANA GUARDIAN

“Terapias a la carta individualizadas para un solo paciente ya no son un sueño”, coincide Marc Güell, especialista en biología sintética traslacional de la Universitat Pompeu Fabra (UPF), en declaraciones a Science Media Centre. Para Güell, es una investigación “totalmente extraordinaria” que “refleja el gran potencial de la edición génica con fines terapéuticos” y que “aporta mucha luz hacia el futuro”.
El primer paciente que ha recibido la terapia de edición genética individualizada, identificado como KJ, mostró síntomas de letargo y dificultad respiratoria a las pocas horas de nacer. Un análisis de sangre reveló un nivel excesivo de amonio, que causa daños neurológicos irreversibles. Un análisis genómico identificó de inmediato la causa del problema.

Los médicos Kiran Musunuru y Rebecca Ahrens-Nicklas, con el pequeño KJ, que he recibido una terapia de edición genética individualizada
En una persona sana, el amonio se produce de manera natural por la descomposición de las proteínas y se elimina convirtiéndose en urea, que se excreta con la orina. Pero a KJ le fallaba la enzima CPS1, imprescindible para convertir el amonio en urea, debido a la desafortunada conjunción de dos variantes genéticas patológicas, una heredada de su padre y la otra de su madre.
La deficiencia de CPS1 afecta a aproximadamente uno de cada 500.000 recién nacidos, de los que la mitad mueren en la primera infancia y la otra mitad sobrevive con daños neurológicos. Médicos e investigadores del hospital de Niños de Filadelfia y de la Universidad de Pensilvania iniciaron una carrera contrarreloj para desarrollar una terapia génica para KJ.
Unos tres millones de personas en España tienen una enfermedad rara, según datos de la federación Feder
En apenas seis meses realizaron todos los pasos necesarios para poder administrársela. Crearon un editor genético a la carta para corregir el fallo concreto que tenía KJ. Lo empaquetaron en nanopartículas lipídicas para que llegara hasta el hígado, que es donde debe actuar. Criaron ratones con deficiencia de CPS1 y les inocularon las nanopartículas para comprobar su eficacia. Las administraron a macacos cangrejeros para comprobar su seguridad. Con los resultados de estos ensayos, solicitaron autorización a la Agencia de Alimentos y Fármacos (FDA) de EE.UU. Para administrar la terapia a KJ. Y en solo una semana la FDA les dio luz verde.
KJ recibió el tratamiento por vía endovenosa a finales de febrero, 208 días después de nacer. Hasta entonces, para evitar los daños del amonio en el cerebro, le habían alimentado restringiendo las proteínas, le habían dado medicación para prevenir la formación de amonio y le habían aplicado terapia renal sustitutiva. Tras recibir la primera infusión de la terapia de edición genética, le aumentaron la cantidad de proteínas de su dieta pero no le pudieron retirar la medicación.
Los médicos han tardado solo seis meses en corregir el gen defectuoso en las células del pequeño JK
Al ver que su evolución era favorable, los médicos le administraron de nuevo la terapia genética con una dosis más alta a mediados de marzo, 22 días después de la primera infusión, lo que permitió reducirle la medicación y continuar normalizando la cantidad de proteínas de la dieta.
Le han administrado una tercera dosis en abril y “ahora está creciendo bien y progresando”, informa el Hospital de Niños de Filadelfia en un comunicado. Pero “es necesario un seguimiento más largo para evaluar la seguridad y eficacia [del tratamiento], así como la salud neurológica del paciente”.
“Me parece un milagro científico que ha permitido curar una enfermedad severa muy minoritaria y aporta conocimiento para tratar muchas otras enfermedades”, apunta Gemma Marfany, catedrática de genética de la Universitat de Barcelona, en declaraciones a Science Media Centre.
“Se podrían desarrollar terapias similares para cientos de errores congénitos de metabolismo del hígado”, escriben los autores del avance en The New England Journal of Medicine. Estas terapias se podrían desarrollar en menos tiempo ya que, al utilizar la misma tecnología, los estudios en ratones y en primates “podrían no ser necesarios para futuros tratamientos individualizados”.